Científicos Reviven Proteínas de Hace 4,000 Millones de Años y Descubren el Origen de la Vida Primitiva
16 Dic. 2025
-
La recreación de proteínas ancestrales permite reconstruir cómo funcionaban los primeros sistemas biológicos
-
El avance abre nuevas rutas para comprender la evolución temprana de la vida en la Tierra
Redacción / CAMBIO 22
En lo más profundo del pasado terrestre, cuando la vida apenas esbozaba sus primeros balbuceos moleculares, ya estaban ahí: silenciosas, precisas, invisibles, pero fundamentales. Las chaperoninas, guardianas del orden biológico, facilitaban que otras proteínas alcanzaran su forma funcional en un entorno aún hostil e incipiente. Ahora, miles de millones de años después, un equipo de científicos ha logrado traerlas de vuelta, reconstruyendo versiones ancestrales de estas proteínas para comprender mejor cómo surgió la complejidad celular que hoy sustenta toda forma de vida en la Tierra.
Este logro ha sido posible gracias a la colaboración entre el Centro de Astrobiología (CAB-CSIC-INTA) y el Centro Nacional de Biotecnología (CNB-CSIC), instituciones que han logrado sintetizar en laboratorio proteínas que podrían haber existido hace entre 3.600 y 4.000 millones de años. El trabajo, recientemente publicado en la revista Molecular Biology and Evolution, no solo supone una hazaña tecnológica, sino también una ventana al pasado que nos habla de los primeros pasos de la evolución molecular.
Talleres celulares
Las chaperoninas, a diferencia de las simples proteínas, no se limitan a cumplir una función aislada: son ensamblajes sofisticados que operan como verdaderos talleres celulares. Su tarea consiste en asistir a otras proteínas en el delicado arte de plegarse correctamente, ensamblarse en complejos o incluso replegarse tras sufrir daños estructurales. El fallo de este sistema puede tener consecuencias dramáticas, como la aparición de enfermedades neurodegenerativas o ciertos tipos de cáncer.
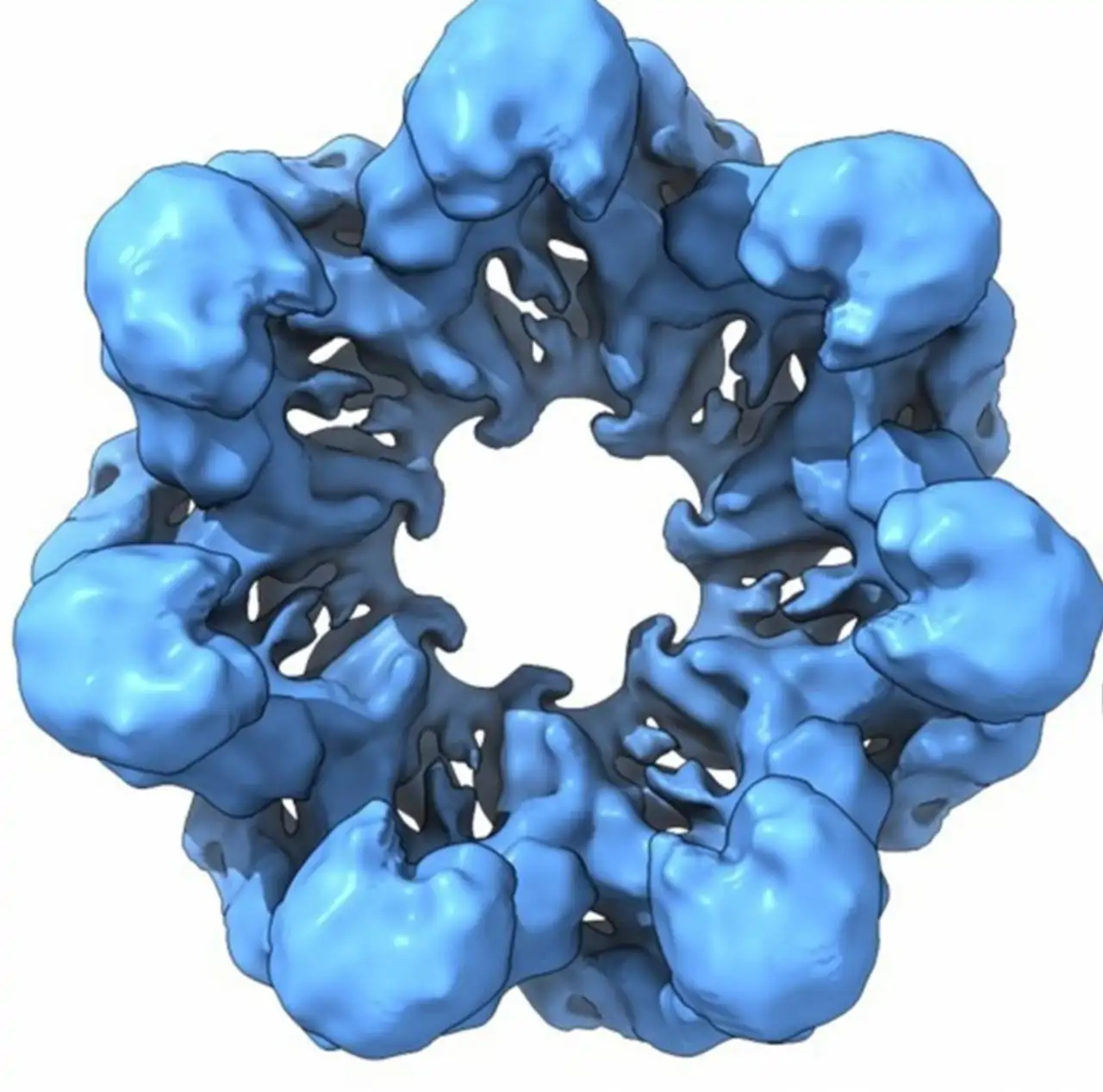
En este nuevo estudio, los investigadores han logrado algo sin precedentes: reconstruir la estructura tridimensional de versiones ancestrales de estas proteínas, basándose en modelos bioinformáticos que combinan datos de chaperoninas actuales de bacterias, arqueas y eucariotas.
Las proteínas resucitadas se comportan de forma sorprendentemente similar a sus descendientes modernas, protegiendo otras proteínas del daño inducido por calor, pese a que presentan diferencias de entre un 30 % y 40 % en su secuencia. Uno de los hallazgos más interesantes del estudio es que las chaperoninas más antiguas estaban formadas solo por un anillo simple con siete partes, a diferencia de las versiones actuales, que son más complejas y tienen una estructura de doble anillo, parecida a un barril.
Esto indica que, al principio, estas proteínas funcionaban de forma más sencilla y probablemente eran menos eficientes. Con el tiempo, fueron evolucionando hacia formas más sofisticadas, adaptándose a las necesidades crecientes de los organismos.
Implicaciones
La posibilidad de recrear y estudiar proteínas tan antiguas no solo es una hazaña de reconstrucción histórica: tiene aplicaciones prácticas en múltiples áreas. Las chaperoninas ancestrales podrían ser útiles en procesos industriales, como en la producción de detergentes enzimáticos más resistentes o en procedimientos que exijan soportar condiciones extremas de temperatura o estrés químico.
Así, al revivir proteínas del pasado, los científicos no solo descifran el lenguaje perdido de la vida primitiva, sino que también escriben nuevos capítulos en la historia de la innovación científica. Porque, al fin y al cabo, entender el origen de nuestras piezas moleculares más básicas no es solo mirar atrás: es una forma audaz de mirar hacia adelante.
Fuente: National Geographic
GPC/MER